
تحقیق درباره ی نقطه جوش
نقطه جوش 3
اندازه گی ری نقطه جوش به روش میکرو: 4
تعییننقطهذوب ( melting point ) 6
نگاه کلي 8
انواع تقطير 8
فرايندتقطيرجزء به جزء 11
تقطيرجزء به جزء مخلوطهاي دو جزئي و چند جزئي 12
تقطیر ساده: 12
انواع تقطیر 13
مراحل تقطیر با استفاده از قانون رائول 17
تعادل بخار با محلول آزئوتروپ 18
بخش عملیتقطیر بابخارآببروموبنزن 23
بلور 25
آب تبلور به چه معناست؟ 28
فرایندتبلور 31
تاریخچه بلورشناسی 31
تبلورو نمو بلورها 31
تبلورمواد محلول: 32
تبلوردر هنگام تبدیل حالت بخار به جامد سوبلیماسیون 33
تبلورمواد جامد 33
تاثیر عوامل خارجی در نمو بلورها 33
میانبار یا ادخال در بلورها 34
اجتماع بلورها 34
اجتماع کروی (اسفرولیتی): 35
ریشه لغوی 36
اطلاعات اولیه 36
سیر تحولی رشد 36
توصیف کروماتوگرافی 36
روشهای کروماتوگرافی 37
انواع کروماتوگرافی 37
مزیت روشهای کروماتوگرافی 38
انتخاب بهترین روش کروماتوگرافی 39
کروماتوگرافی تبادل یونی 40
روماتوگرافي Chromatography: 42
روش کار: 44
خواص فيزيکی الکلها: 46
خواص شيميايي آلدهيد ها و كتون ها: 47
تهيه آلدهيد ها و كتون ها از راه اكسايش الكل ها: 47
منبع: 50
نقطه جوش
مولکولهای مایع دائما حرکت میکنند.تعدادی از این مولکولها هنگامی که در سطح مایع هستند میتوانند به فضای بالای مایع بگریزند.مایعی را در ظرف بسته ای که هوایش تخلیه شده در نظر بگیرید.تعداد مولکولها در فاز گازی مایع افزایش مییابد تا سرعت ورود مجدد مولکولها به فاز مایع با سرعت گریزشان برابر شود، سرعت ورود مجدد متناسب با تعداد مولکولها در فاز گازی است.در این حال دیگر تغییر اساسی در دستگاه ملاحظه نمی شود و میگویند که سیستم در حال تعادل جنبشی است.مولکولها در فاز گازی به سرعت حرکت میکنند و دائما به دیواره ظرف بر میخورند و منجر به وارد کردن فشار به دیواره آن میشوند میزان این فشار در یک درجه حرارت معین را فشار بخار تعادل جسم مایع در آن درجه مینامند.این فشار بخار به درجه حرارت بستگی دارد.این بستگی به آسانی با تمایل گریز مولکولها از مایع قابل توجیه است.با ازدیاد درجه حرارت انرژی جنبشی متوسط مولکولها افزایش مییابد و فرار آنها به فاز گازی آسان میشود.سرعت ورود مجدد مولکولها نیز رو به افزایش میرود و به زودی در درجه حرارت بالاتر تعادل برقرار میشود.ولی در این حال تعداد مولکولها در فاز گازی از تعداد آنها در درجه حرارت پایین تر بیشتر است و در نتیجه فشار بخار زیادتر است.
اکنون نمونه مایعی را در نظر بگیرید که در یک درجه حرارت معین در ظرف سر گشاده ای قرار دارد و مولکولهای فاز بخار در بالای مایع میتوانند از محوطه ظرف خارج شوند.بخاری که در بالای این نمونه است از مولکولهای هوا و نمونه تشکیل شده است.طبق قانون فشارهای جزئی دالتون، فشار کل (خارجی) در بالای مایع برابر با فشارهای جزئی نمونه و هوا است:
هواP+ نمونهP = کلP
فشار جزئی نمونه برابر با فشار بخار تعادل آن در درجه حرارت معین است.اگر درجه حرارت بالا رود (بدین ترتیب فشار بخار تعادل نمونه زیاد میشود)، تعداد مولکولهای نمونه در فضایی که در بالا و نزدیک مایع است افزایش مییابد و در نتیجه مقداری از هوا جابجا میشود.در درجه حرارت بالا فشار جزئی نمونه درصد بیشتری از فشار کل را تشکیل میدهد.با ازدیاد بیشتر درجه حرارت این عمل ادامه مییابد تا فشار بخار تعادل با فشار خارجی برابر شود و در این حال تمام هوا کاملا از ظرف خارج میشود.تبخیر بیشتر باعث جابجا شدن مولکولهای گازی نمونه خواهد شد.با توجه به این حقایق به این نتیجه میرسیم که فشار بخار تعادل یک نمونه یک حد نهایی دارد که به وسیله فشار خارجی معین میشود.در این حد سرعت تبخیر به مقدار زیادی افزایش مییابد (که با تشکیل حباب در مایع آشکار میشود) و این مرحله را عموما شروع جوشش میدانند.نقطه جوش یک مایع درجه حرارتی است که در آن فشار بخار مایع کاملا برابر با فشار خارجی شود.چون نقطه جوش مشاهده شده مستقیما به فشار خارجی بستگی دارد، از این جهت باید در گزارش نقطه جوش، فشار خارجی هم قید شود (مثلا نقطه جوش 152 درجه سانتیگراد در فشار 752 میلی متر جیوه).معمولا نقطه جوش استاندارد را در فشار آتمسفر (760 mm Hg) تعیین میکنند.
نقاط جوش برای شناسایی مایعات و برخی از جامداتی که در حرارت پایین ذوب میشوند، مفید هستند.جامداتی که در حرارت بالا ذوب میشوند معمولا آنقدر دیر میجوشند که نمیتوان به راحتی درجه جوش آنها را اندازه گر فت.
بخش عملی
اندازه گی ری نقطه جوش به روش میکرو:
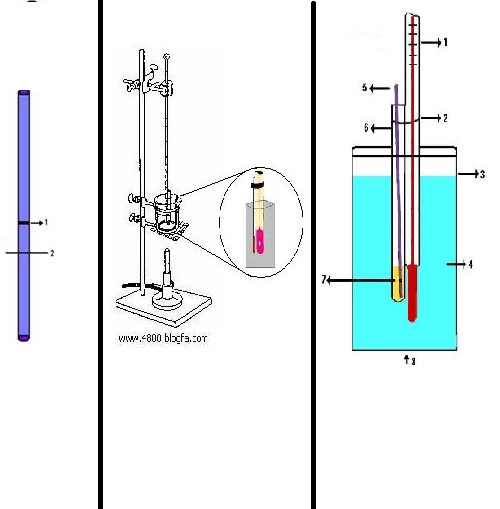
انتهای دو لوله مویین تمیز یک میلی متری را به وسیله حرارت شعله بسته و به هم متصل کنید و در حدود سه یا چهار میلی متر پایین تر آنرا صاف ببرید مانند شکل 1 (1- محل اتصال 2- محل برش).
یک لوله شیشه ای 4 میلی متری مطابق شکل 2 تهیه کنید و آنرا با یک حلقه لاستیکی به یک گرما سنج متصل کنید حدود 2 قطره از مایع مورد آزمایش را به کمک پیپت مویین در انتهای لوله 4 میلی متری قرار دهید و لوله مویین جوش را در آن داخل کنید چنانچه سطح نمونه مایع در زیر محل اتصال لوله مویین باشد آنقدر از نمونه اضافه کنید تا سطح مایع به بالای اتصال برسد. گرماسنج و لولههای متصل به آنرا در داخل حمامی که بتوان آنرا گرم کرد قرار دهید و مواظب باشید که حلقه لاستیکی در بالای سطح مایع باشد.درجه حرارت را به سرعت بالا ببرید تا حبابهای تند و مداومی از لوله مویین جوش خارج شود.در این حال حرارت را قطع کنید.با سرد شدن تدریجی حمام سرعت خروج حباب کم میشود.در لحظه ای که خروج حباب کاملا متوقف میشود و مایع شروع به بالا رفتن از داخل لوله مویین میکند درجه حرارت گرما سنج را یادداشت کنید.این درجه، نقطه جوش نمونه مایع است.
شکل2:1-دماسنج 2-بند لاستیکی 3-بشر 4-پارافین مایع 5-لوله مویین 6-لوله با قطر 4 میلیمتر 7- مایع نمونه 8-شعله
تعیین نقطه ذوب ( melting point )
نقطه ذوب دمایی است که جامد به مایع تبدیل و یا دمایی که در ان فشار بخار مایع و جامد برابرند.زمانیکه یک جامد در اثر حرارت ذوب میگردد با پدیدارشدن مایع بین مایع و جامد تعادل برقرار میگردد و ادامه گرما باعث تبدیل جامد به مایع میگردد.معمولا ماده الی خالص دارای نقطه ذوب معین و بسیار سریع میباشد.
وجود مقدار کم ناخالصی نقطه ذوب را تغییر میدهد لذا داشتن نقطه ذوب جسم خالص ونتیجه حاصله از یک ازمایش خلوص جسم را تعیین میکند.( در این مورد استسنائاتی هم وجود دارد )
روش میکرو
یک لوله موئین به طول 7 – 5 سانتی متر برداشته یک دهانه ان را با استفاده از شعله مسدود کنید.
نمونه جامد مورد نظر را کاملا پودر کرده و وارد لوله موئین کنید ( لوله موئین 5 – 7 سانتی متر پر شود )
لوله موئین را طوری به ترمومتر متصل نمایید که انتهای لوله و ترمومتر هم سطح باشند ( این کار را به کمک سیم یا حلقه نازک و کوچک لاستیکی انجام دهید ولی نباید در حمام قرار گیرد )
ترمومتر اماده شده را به کمک گیره و پایه طوری به حالت اویزان درون حمام قرار دهید که مخزن ترمومتر و ماده جامد درون مایع قرار گیرند.( مایع حمام معمولا از پارافین – گلی کول – گلیسیرین – اسید سولفوریک غلیظ که نقطه جوش بالایی دارند استفاده میشود)
سپس حمام را به ارامی حرارت دهید به طوری که ماکزیمم هر یک دقیقه دو درجه سانتیگراد بالا رود.دمای شروع نقطه ذوب و دمایی که در ان اخرین قسمت جامد دوب میگردد را یاداشت کنید.تفاضل این دو عدد را در اصطلاح دامنه ذوب میگویند.
دامنه ذوب ترکیبات خالص معمولا 2 – 0.5 درجه سانتیگراد است.
روش ماکرو
دمای ذوب را میتوان به روش ماکرو بدست اورد و ملاحظه نمود که در طول ذوب دما ثابت است.انواع دستگاههای ساده الکتریکی برای تعیین نقطه ذوب ترکیبات الی به روش ماکرو وجود دارد
خش عملی تعیین نقطه ذوب
مقدار کمی از نمونه پودر شده را در روی یک شیشه ساعت کوچک بگذارید، یک طرف لوله مویین را با شعله ببندید و چند بار نوک باز لوله مویین را آهسته به داخل جسم جامد بزنید.با برگرداندن لوله و با زدن سریع انتهای بسته لوله بر روی یک سطح محکم میتوان جسم جامد را به طرف انتهای بسته لوله هدایت کرد.جسم باید در لوله متراکم شود.بهترین راه انجام این کار آن است که در خاتمه لوله مویین را از درون یک قطعه لوله شیشه ای بزرگتر که تقریبا به طول 60 سانتیمتر باشد، بر روی سطح محکمی رها کنید.نمونه باید به اندازه ای باشد که پس از عمل تراکم لوله مویین را تا عمق 3-2 میلی متر پر کند.این مقدار نباید بیشتر باشد.لوله مویین را به وسیله یک بند لاستیکی کوچک به گرماسنج متصل کنید.خود نمونه باید در مجاورت حباب گرماسنج باشد و بند لاستیکی در بالا ترین جا تا از سطح مایع داغ دور باشد.سپس گرماسنج را به کمک چوب پنبه سوراخداری که یک طرف آن بریده شده در داخل گرمکن قرار دهید.منظور از این بریدگی آن است که درجات گرماسنج در آن حدود آشکار شوند و همچنین دستگاه یک سیستم باز باشد.(احتیاط:هرگز نباید یک سیستم بسته را حرارت داد.) با استفاده از حرارت یک چراغ کوچک بونزن به آرامی درجه حرارت مایعی را که باید گرم شود بالا ببرید (حدود 2 درجه در دقیقه) درجه ای را که ابتدا عمل ذوب مشاهده میشود و همچنین درجه ای را که در آن آخرین قسمت جامد ذوب میشود را یادداشت کنید.
نگاه کلي
روشهاي مختلفي براي جداسازي مواد اجزاي سازنده يک محلول وجود دارد که يکي از اين روشها فرايندتقطير ميباشد در روشتقطيرجداکردن اجزاء يک مخلوط، از روي اختلافنقطه جوشآنها انجام ميگيرد.تقطيردر عمل به دو روش زير انجام ميگيرد.روش اول شامل توليد بخار از طريقجوشاندن يک مخلوط مايع، سپس ميعان بخار، بدون اينکه هيچ مايعي مجددا بهمحفظهتقطيربازگردد.در نتيجه هيچ مايع برگشتي وجود ندارد.در روش دوم قسمتي از بخار مايع شده به دستگاهتقطيرباز ميگردد و به صورتي که اينمايع برگشتي در مجاورت بخاري که به طرف مبرد ميرود قرار ميگيرد.هر کدام از اين روشها ميتوانند پيوسته يا ناپيوسته باشند.
انواعتقطير
قطيرسادهغير مداوم:در اين روشتقطير، مخلوط حرارت داده ميشود تا بحال جوش درآيد بخارهايي که تشکيل ميشودغني از جزء سبک مخلوط ميباشد پس از عبور از کندانسورها (ميعان کننده ها) تبديل به مايع شده، از سيستمتقطيرخارج ميگردد.به تدريج که غلظت جزء سنگين مخلوط در مايع باقي مانده زيادميشود، نقطه جوش آن بتدريج بالا ميرود.به اين ترتيب، هر لحظه از عملتقطير، ترکيب فازبخارحاصل و مايع باقي مانده تغيير ميکند.
تقطيرسادهمداوم:در اين روش، مخلوط اوليه (خوراک دستگاه) بطور مداوم با مقدار ثابت درواحد زمان، در گرم کننده گرم ميشود تا مقداري از آن بصورت بخار درآيد، وبه محض ورود در ستونتقطير، جزء سبک مخلوط بخار از جزء سنگين جدا ميشود و از بالاي ستونتقطيرخارج ميگردد و بعد از عبور از کندانسورها، به صورت مايع در ميآيد جزء سنگين نيز از ته ستونتقطيرخارج ميشود.قابل ذکر است که هميشه جزء سبک مقداري جزء سنگين و جزء سنگين نيز داراي مقداري از جزء سبک است.
تقطيرتبخير آني (ناگهاني):وقتي محلول چند جزئي مانندنفت خامراحرارت ميدهيم، اجزاي تشکيل دهنده آن بترتيب که سبکتر هستند، زودتر بخارميشود.برعکس وقتي بخواهيم اين بخارها را سرد و دوباره تبديل به مايعکنيم، هر کدام که سبکتر باشد ديرتر مايع ميگردد.با توجه به اين خاصيت،ميتوانيم نفت خام را به روش ديگري که به آن "تقطيرآني" گويند،تقطيرنماييم.در اين روش، نفت خام را چنان حرارت ميدهيم که ناگهان همه اجزايآن تبديل به بخار گردد و سپس آنها را سرد ميکنيم تا مايع شود.در اينجا،بخارها به ترتيب سنگيني، مايع ميشوند يعني هرچه سنگينتر باشند، زودترمايع ميگردند و بدين گونه، اجزاي نفت خام را با ترتيب مايع شدن از همجدا ميکنيم.
تقطيردر خلا:با توجه به اينکه نقطه جوش مواد سنگين نفتي نسبتا بالاست و نياز به دماو انرژي بيشتري دارد، و از طرف ديگر، مقاومت اين مواد در مقابل حرارتبالا کمتر ميباشد و زودتر تجزيه ميگردند، لذا براي جداکردن آنها از خلانسبي استفاده ميشود.در اين صورت مواد دماي پايينتر از نقطه جوش معموليخود به جوش ميآيند.در نتيجه،تقطيردر خلا،دو فايدهدارد:اول اين که به انرژي و دماي کمتر نياز است، دوم اينکه مولکولها تجزيه نميشوند.امروزه در بيشتر موارد در عملتقطير، از خلا استفاده ميشود.يعني اين که:همتقطيرجزء به جزء و همتقطيرآني را در خلا انجام ميدهند.
تقطيربه کمک بخار آب:يکي ديگر از طرقتقطيرآن است که بخار آب را در دستگاهتقطيروارد ميکنند در اين صورت بي آنکه خلاءاي ايجاد گردد، اجزاي نفت خام در درجه حرارت کمتريتبخير ميشوند.اين مورد معمولا در زماني انجام ميشود که در نقطه جوش آب، فشاربخار اجزاي جداشونده بالا باشد تا به همراه بخار آب از مخلوط جدا گردند.
تقطيرآزئوتروپي:از اين روشتقطيرمعمولا در مواردي کهنقطه جوش اجزاء مخلوط بهم نزديک باشنداستفاده ميشود، جداسازي مخلوط اوليه، با افزايش يکحلال خاص که با يکي از اجزاي کليدي،آزئوتوپتشکيل ميدهد امکانپذير است.آزئوتروپ محصولتقطيريا ته مانده را از ستون تشکيل ميدهد و بعد حلال و جزء کليدي را از هم جداميکند.اغلب، ماده افزوده شده آزئوتروپي با نقطه جوش پايين تشکيل ميدهدکه به آن شکننده آزئوتروپ ميگويند.آزئوتروپ اغلب شامل اجزاي خوراک است،اما نسبت اجزاي کليدي به ساير اجزاي خوراک خيلي متفاوت بوده و بيشتر است.
شامل ورد51صفحه ای میباشد
:: موضوعات مرتبط:
شیمی ,
,
:: برچسبها:
نقطه جوش ,
تحقیق نقطه جوش ,
